研究者の方へ(臨床研究を始められる方へ)
臨床研究(人を対象とする生命科学・医学系研究)とは
「人を対象とする生命科学・医学系研究に関する倫理指針」(参考:本文/ガイダンス)では、人を対象とする生命科学・医学系研究を以下のように定義しています。
人を対象として、次のア又はイを目的として実施される活動をいう。
ア 次の①、②、③又は④を通じて、国民の健康の保持増進又は患者の傷病からの回復若しくは生活の質の向上に資する知識を得ること
① 傷病の成因(健康に関する様々な事象の頻度及び分布並びにそれらに影響を与える要因を含む。)の理解
② 病態の理解
③ 傷病の予防方法の改善又は有効性の検証
④ 医療における診断方法及び治療方法の改善又は有効性の検証
イ 人由来の試料・情報を用いて、ヒトゲノム及び遺伝子の構造又は機能並びに遺伝子の変異又は発現に関する知識を得ること
上記に該当する研究の実施には、倫理審査委員会の承認及び研究機関の長の許可を受ける必要があります。
※研究分担者として参加する場合も、研究計画書に研究分担者として記載され、その計画書が倫理審査委員会の承認及び研究機関の長の許可を受けていることが必要です。(研究計画書への記載、倫理審査申請は電子申請システムにより行います)
*本ページは、「人を対象とする生命科学・医学系研究」を実施する場合の説明です。
特定臨床研究については→ 特定臨床研究
中央一括倫理審査(本学が多機関共同研究の共同研究機関として外部に審査を依頼する場合)、試料情報提供機関の場合についての案内等は
→ 中央一括倫理審査・その他外部倫理審査関係
1.倫理審査電子申請システムへのユーザー登録
倫理審査申請は電子申請システムによって行います。まず以下のガイドに従って電子申請システムのユーザー登録を行ってください。
*学内専用(学外からもアクセス可能ですがBoxへのログインが必要です)
2.講習会(ICR-web・eAPRIN)の受講
倫理指針において研究者等は「研究の実施に先立ち、また、研究期間中も適宜継続して教育・研修を受けなければならない。」とされています。
本学では、「ICR-web E-ラーニング」(学内講習会、年1回(年度ごと))と「eAPRIN」(5年ごと)の受講を必須としております。
※研究計画書に記載のある全員の講習会受講が完了していませんと、倫理審査申請ができません。
*「ICRweb E-ラーニング(東京女子医科大学コース)(学内講習会)」の項と、その項の末尾にある「(参考)eAPRINを含む研究倫理等に関するご案内」をご参照ください。
3.電子申請システムによる倫理審査申請
電子申請システムから申請を行います。
申請書作成の具体的な手順は
→システムの使い方ガイド<倫理審査申請編> P2~P18
*電子申請システムにログインが必要です
4.倫理審査~研究の開始
電子申請システムで「申請」を押した後の流れ
|
責任者決裁・利益相反自己申告 |
| ▼ |
|
(申請書類に審査に差し障る不備等があった場合、 |
| ▼ |
|
審査 |
※迅速審査:順次受付・審査(3~4週間程度) |
| ▼ |
|
審査結果通知 (条件付き承認の場合、修正後再提出) |
| ▼ |
|
承認・機関の長による決裁・研究実施許可 |
| ▼ |
|
研究の開始 |
※責任者決裁・申請書に名前のある全員の利益相反自己申告が完了しないと受理されず審査に進みません。
※迅速審査の場合電子会議室で順次審査が行われます。審査結果が出るまでに概ね3~4週間程度かかります。迅速審査・対面審査のいずれかは研究内容等によって判断され、申請者が選ぶことはできません。
※審査状況は申請者自身が確認できます。研究課題詳細表示画面、もしくは申請書閲覧画面の最下部に表示されています。該当箇所がご不明であれば上の「電子申請システム問い合わせ対応フォーム」をご利用ください。
「申請したが審査が進んでいないようだ/審査の進捗を知りたい」を選択して「次へ」を押していただくと、画像つきの説明、システムメインメニュー画面へのリンクが表示されます。
5.(研究継続中)実施状況報告・研修の受講
研究を開始した後は、年1回の実施状況報告・研修の受講が必要です。
<実施状況報告>
毎年1月頃に、継続中の研究の申請者に対し当該研究の実施状況報告を依頼するメールが電子申請システムより送られます。メールが来たら速やかにご対応ください。
(実施状況報告は指針に定められた責務となっております。必ず行ってください)
<研修の受講>全員
ICR-webの所定の講義を年1回(年度ごとに)受講してください。→研修のご案内
6.(研究期間が終了した場合・研究が中止になった場合)終了(中止)報告
研究期間の終期となり、研究が終了したら必ず終了報告をしてください。研究計画書上の終了日が近づくと電子申請システムより終了報告を案内するメールが送られます。
研究期間の途中で研究が中止となった場合も終了報告をお願いいたします。(終了報告の画面で、「中止」が選択できます)
計画より研究期間を延長する場合は、研究期間の終了前に研究期間延長の計画変更申請を行ってください。承認まで時間がかかることを考慮し、余裕をもって申請してください。期間延長の承認が下りる前に研究期間が終了した場合、当該研究の実施はできません。研究を中断していただきます。
※他機関が主管の多機関共同研究で、主管の研究は継続されるが本学は終了とする場合は、主管機関の方で共同研究機関から本学を外す計画変更申請をしていただく必要があります。
7.(研究計画に変更が生じた場合)計画変更申請
承認されている研究計画に変更が生じた場合、計画変更申請をして承認される必要があります。
<このような場合も変更申請が必要です>
・研究期間が変更になった
・研究分担者に変更(追加・削除)が生じた
※医学部学生を当該研究に参加させる場合も原則必要です(電子申請または書類による審査)。詳しくは学務課からの案内を参照してください。
・研究責任者が変更になった
※研究責任者が退職した場合の他、非常勤になった場合も変更が必要
変更申請の方法は
→システムの使い方ガイド<倫理審査申請編> P20、P5~P18
*電子申請システムにログインが必要です
*P5~は「新規申請」というタイトルですが、変更申請の際の説明もあります
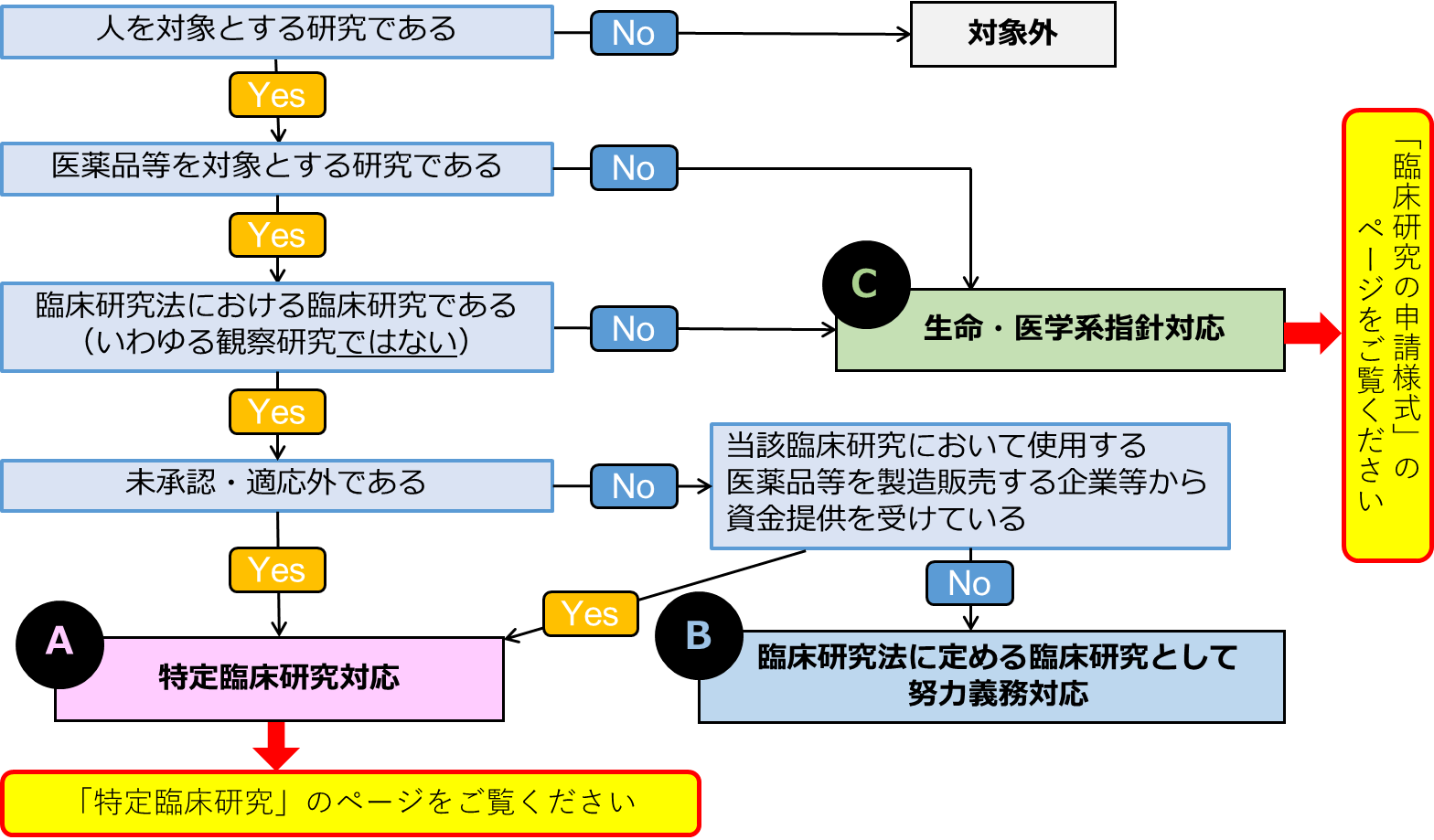
臨床研究法による臨床研究の分類
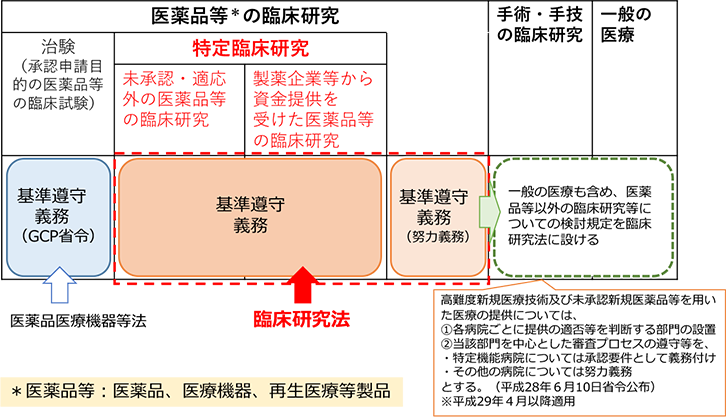
臨床研究の種類と判定フロー