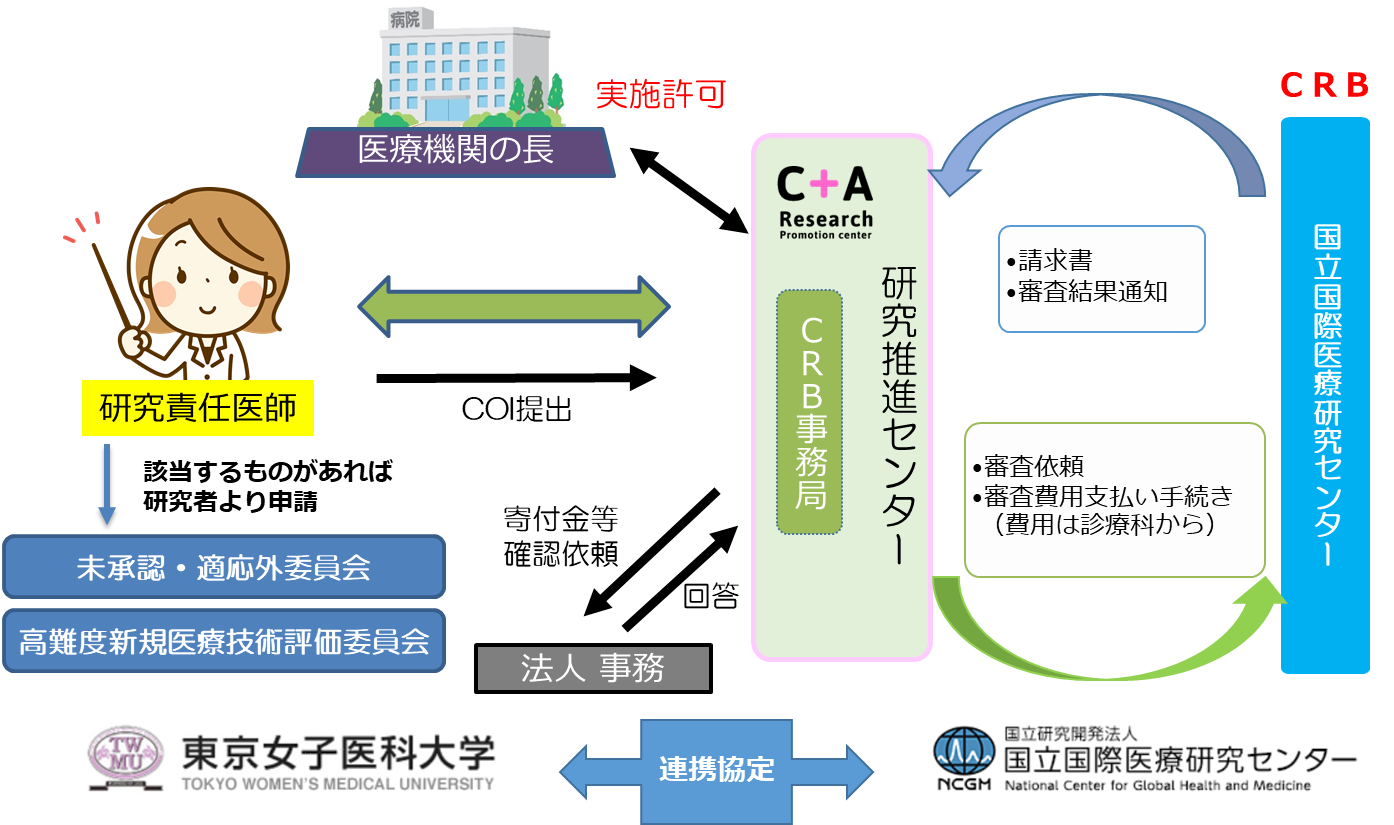
特定臨床研究
【研究推進センター 臨床研究支援室(CRB担当)】![]()
はじめに ~規制法令・指針等の確認~
参考情報) 厚生労働省 > 臨床研究法について
臨床研究法の概要【PDF】 該当性に関するチェックリスト【PDF】
1.COI(利益相反管理)
利益相反状況の確認は、概ね5名までで1週間、5名以上では2週間程度かかります。
参考情報) 厚生労働省 > COI(利益相反管理)について【PDF】
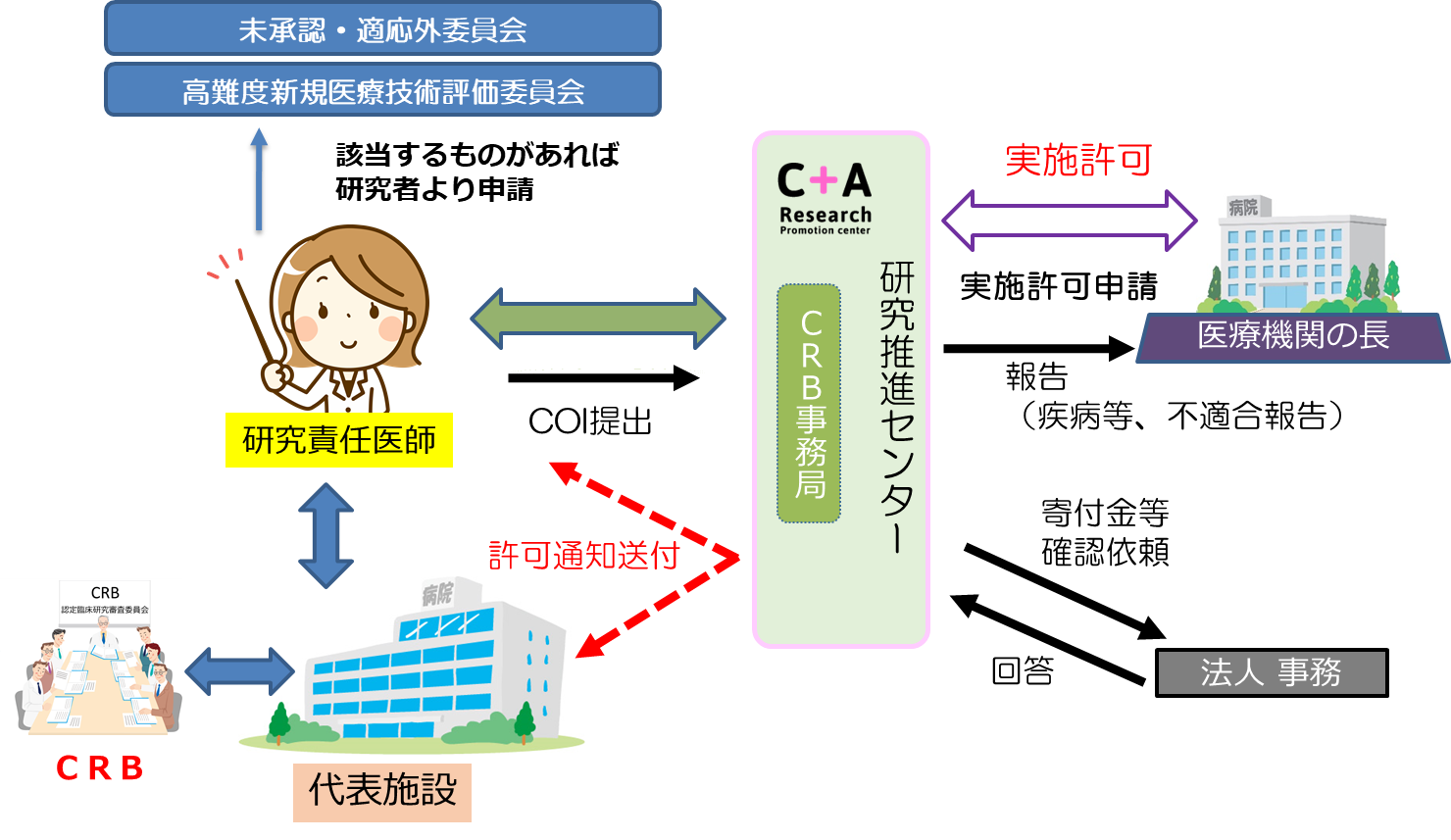
2.管理者実施許可手続き(院長決裁)
認定臨床研究審査委員会(CRB)で承認を得られましたら、「臨床研究実施許可に関する届出書(新規)」と共に承認書類一式をお送りください。
【確認事項】
● 試料・情報の保存期間(注意! 同意説明文書への記載が 本学の規程より短い場合は変更が必要です)
● 用いる医薬品等が未承認・適応外に該当する場合は、未承認・禁忌・適応外医薬品等評価委員会や未承認等新規高度管理医療機器等評価委員会などに研究者より申請
● 臨床研究保険加入状況(女子医大で実施する場合には基本的に女子医大の病院が臨床研究保険でカバーされていることが必要です)
3.報告(疾病、不適合、定期報告等)手続き(院長報告)
認定臨床研究審査委員会(CRB)から報告事項がありましたら、書類一式をお送りください。
4.各種手順書・様式(※学内専用(Box))
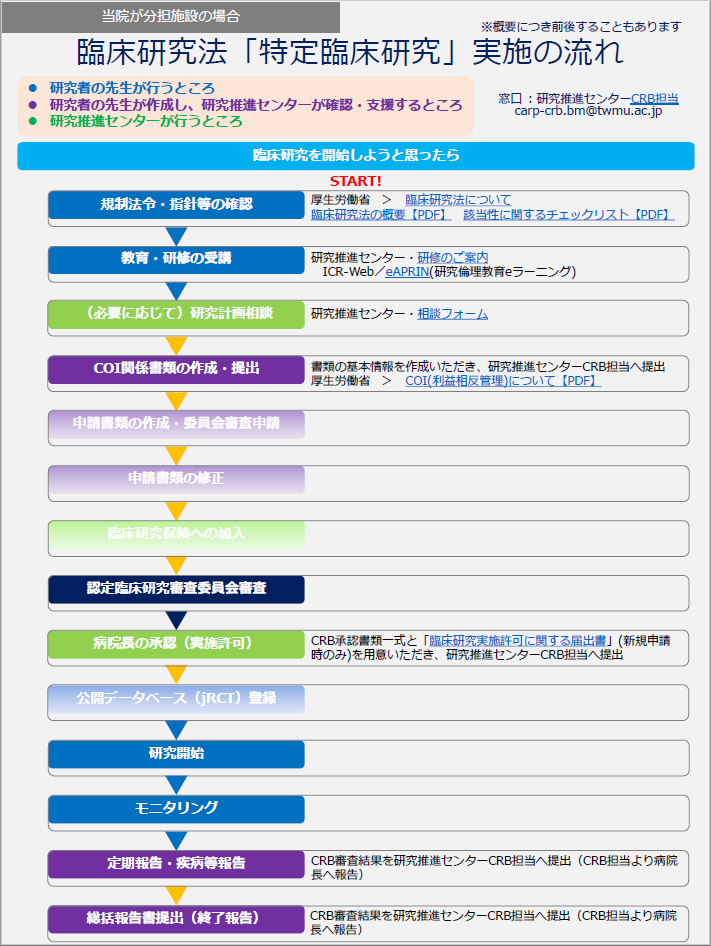
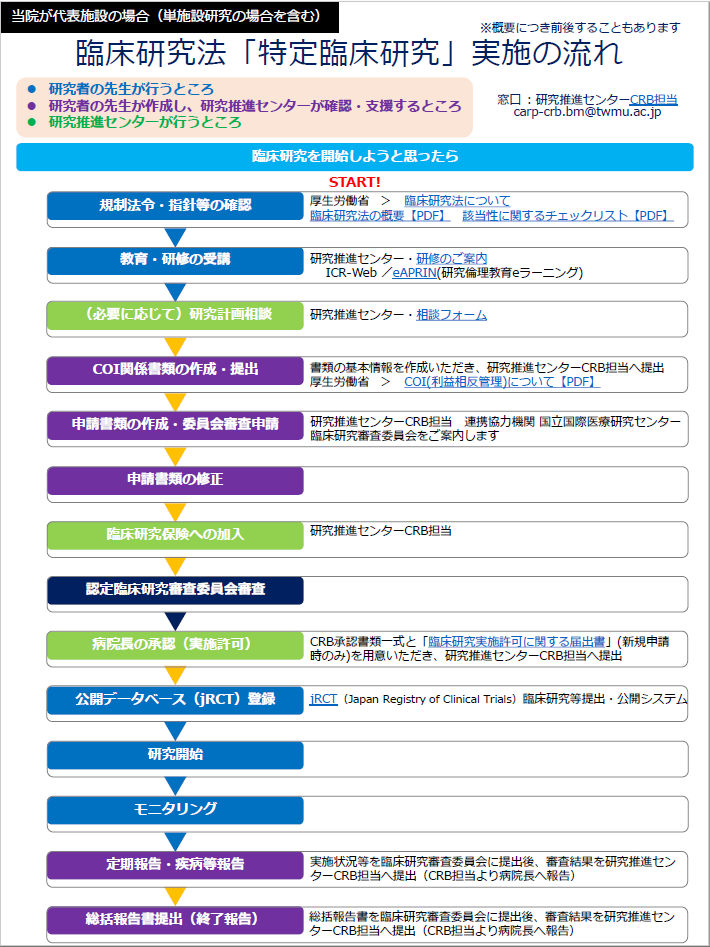
実施の流れ
↓クリックするとPDFファイルが開きます(※学内専用(Box))
| ◆当院が分担施設の場合の流れ | ◆当院が代表施設の場合の流れ |
|
|
当院が分担施設の場合
当院が代表施設の場合(単施設研究の場合を含む)